Dung dịch nào sau đây hòa tan được AlOH3
1. Khái niệm về Al(OH)₃
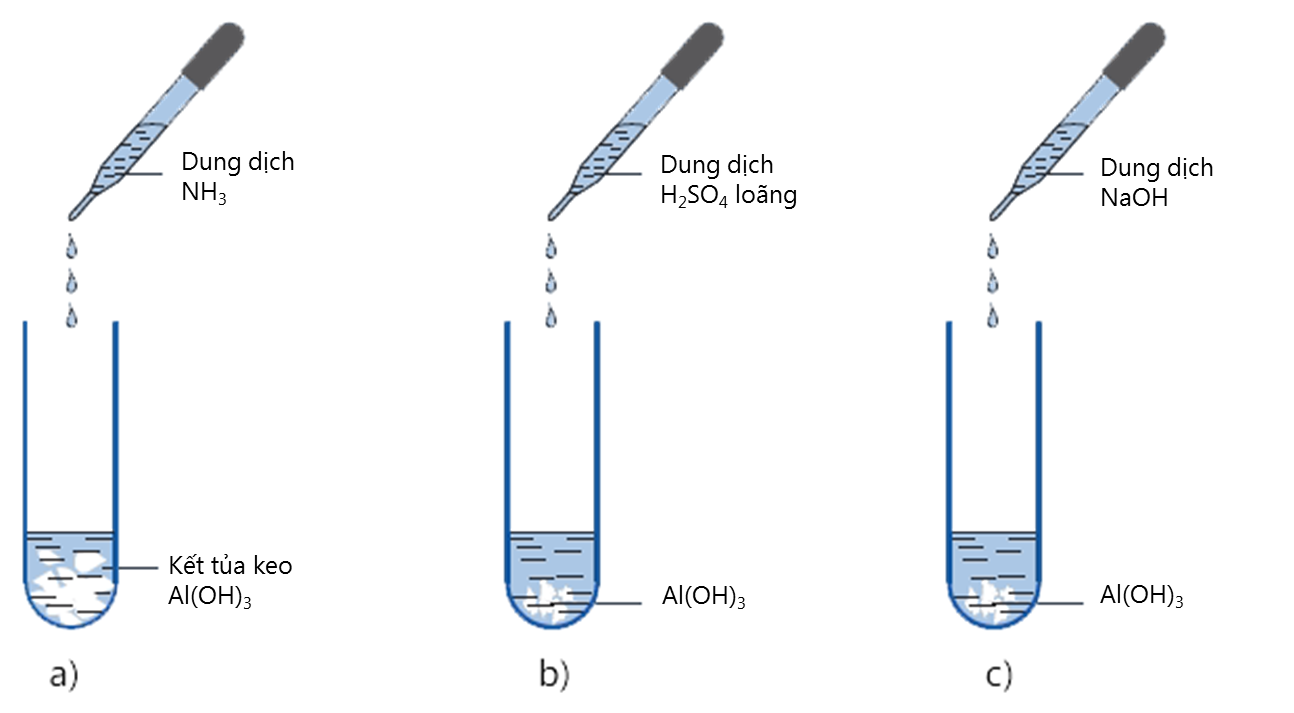
Bản chất hóa học: Al(OH)₃ là nhôm hiđroxit, một hợp chất vô cơ được tạo thành khi ion Al³ ⁺ trong dung dịch phản ứng với ion OH⁻ từ kiềm. Thông thường, khi nhỏ từ từ dung dịch NaOH vào dung dịch muối nhôm (ví dụ AlCl₃), sẽ thu được kết tủa trắng keo Al(OH)₃.
Trạng thái tồn tại: Ở điều kiện thường, Al(OH)₃ tồn tại dưới dạng chất rắn màu trắng, kết tủa, không tan trong nước và rất khó tách khan. Vì có cấu trúc mạng liên kết hiđro bền chặt nên tính tan trong dung môi hầu như bằng không.
Đặc điểm nổi bật: Đây là một hiđroxit lưỡng tính, tức là nó vừa thể hiện tính bazơ (khi tác dụng với axit mạnh), vừa thể hiện tính axit yếu (khi tác dụng với dung dịch kiềm đặc).
2. Tính chất hóa học đặc trưng của Al(OH)₃
Tính lưỡng tính:
Tác dụng với axit: Al(OH)₃ phản ứng dễ dàng với các dung dịch axit mạnh như HCl, H₂SO₄, HNO₃, tạo thành muối nhôm tan và nước. Ví dụ:
Al(OH)₃+3HCl → AlCl₃+3H₂O
Tác dụng với kiềm: Khi gặp dung dịch kiềm dư như NaOH, KOH, Al(OH)₃ tan nhờ tạo thành muối aluminat [Al(OH)₄]⁻:
Al(OH)₃+NaOH → Na[Al(OH)₄]

Các hỗn hợp đặc trưng
Điều này thể hiện rõ sự khác biệt của Al(OH)₃ so với nhiều hiđroxit kim loại khác (chỉ thể hiện một tính chất duy nhất).
Tính không tan trong nước: Mặc dù là hiđroxit, Al(OH)₃ không tan trong nước thường như NaOH hoặc Ca(OH)₂, do có cấu trúc phân tử bền chặt và lực hút ion mạnh. Vì vậy, để hòa tan cần có axit hoặc kiềm mạnh.
Tính chất nhiệt phân: Khi đun nóng, Al(OH)₃ bị phân hủy thành oxit nhôm (Al₂O₃) và nước. Phản ứng:
2Al(OH)₃ → Al₂O₃+3H₂O
Đây cũng là cơ sở để sản xuất oxit nhôm từ các nguồn quặng chứa nhôm hiđroxit.
3. Ý nghĩa và vai trò của Al(OH)₃
Trong học tập: Là một hợp chất điển hình để minh họa cho tính lưỡng tính, thường xuất hiện trong bài tập trắc nghiệm và tự luận. Nó giúp học sinh phân biệt được đâu là hiđroxit có tính bazơ, đâu là hiđroxit có tính axit, và đâu là hiđroxit lưỡng tính.
Trong công nghiệp: Al(OH)₃ được sử dụng làm nguyên liệu sản xuất nhôm oxit (Al₂O₃), sau đó điện phân nóng chảy Al₂O₃ để sản xuất nhôm kim loại.
Trong y học: Một số chế phẩm của Al(OH)₃ được dùng làm chất kháng axit, giúp trung hòa dịch vị axit trong dạ dày.
Trong xử lý môi trường: Nhờ khả năng kết tủa và hấp phụ, Al(OH)₃ cũng được ứng dụng trong việc xử lý nước thải, loại bỏ tạp chất.
1. Hòa tan trong dung dịch axit mạnh
Nguyên nhân: Al(OH)₃ mang tính bazơ yếu nên khi gặp dung dịch axit mạnh (HCl, H₂SO₄ loãng, HNO₃...), nó phản ứng theo cơ chế trung hòa axit– bazơ.
Quá trình: Các ion H⁺ trong dung dịch axit sẽ kết hợp với nhóm OH⁻ trong Al(OH)₃, tạo thành phân tử nước. Lúc này, ion Al³ ⁺ được giải phóng và kết hợp với gốc axit tạo thành muối tan trong nước.
Phản ứng minh họa:
Al(OH)₃+3HCl → AlCl₃+3H₂O
Kết quả: Al(OH)₃ tan hết trong dung dịch axit, chứng minh tính bazơ yếu của nó.
2. Hòa tan trong dung dịch kiềm dư (NaOH, KOH)
Nguyên nhân: Al(OH)₃ không chỉ có tính bazơ mà còn thể hiện tính axit yếu, nên khi gặp dung dịch kiềm dư, nó phản ứng tạo muối aluminat tan.
Quá trình: Các ion OH⁻ từ dung dịch kiềm tấn công ion Al³ ⁺ trong mạng Al(OH)₃, tạo phức aluminat [Al(OH)₄]⁻. Nhờ đó, kết tủa trắng tan dần trong dung dịch kiềm đặc.

Cơ chế hòa tan
Phản ứng minh họa:
Al(OH)₃+NaOH → Na[Al(OH)₄]
Kết quả: Al(OH)₃ tan trong kiềm dư, đây là cơ sở để khẳng định Al(OH)₃ là một hiđroxit lưỡng tính.
3. Sự khác biệt trong cơ chế hòa tan ở axit và kiềm
Trong axit: Ion H⁺ phá vỡ cấu trúc Al(OH)₃ bằng cách trung hòa nhóm OH⁻, tạo nước → cơ chế mang tính trung hòa đơn giản.
Trong kiềm: Ion OH⁻ không chỉ trung hòa mà còn tạo liên kết phối trí với Al³ ⁺, hình thành ion phức [Al(OH)₄]⁻ → cơ chế đặc trưng của hiđroxit lưỡng tính.
Ý nghĩa: Nhờ sự khác biệt này, Al(OH)₃ được xếp vào nhóm hiđroxit đặc biệt, vừa tan trong axit, vừa tan trong kiềm, khác hẳn những hiđroxit chỉ tan trong một môi trường.
4. Ứng dụng từ cơ chế hòa tan
Trong phòng thí nghiệm, phản ứng này thường dùng để kiểm chứng tính lưỡng tính của Al(OH)₃.
Trong công nghiệp luyện nhôm, dung dịch NaOH được dùng để hòa tan Al(OH)₃ và quặng chứa Al₂O₃ (theo phương pháp Bayer).
Trong bài tập Hóa học phổ thông, cơ chế này là chìa khóa để chọn đúng đáp án cho câu hỏi “ Dung dịch nào sau đây hòa tan được AlOH₃” .
1. Các dung dịch axit mạnh hòa tan được Al(OH)₃
Cơ chế: Do Al(OH)₃ thể hiện tính bazơ yếu, nên khi gặp các dung dịch axit mạnh, ion H⁺ sẽ phản ứng với nhóm OH⁻, tạo nước và giải phóng ion Al³ ⁺ để tạo muối tan. Vậy nên dung dịch nào sau đây hòa toạn được Al(OH)₃?
Ví dụ cụ thể:
Với HCl: Al(OH)₃+3HCl → AlCl₃+3H₂O
Với H₂SO₄ loãng: 2Al(OH)₃+3H₂SO₄ → Al₂(SO₄)₃+6H₂O
Với HNO₃: Al(OH)₃+3HNO₃ → Al(NO₃)₃+3H₂O
Kết luận: Các dung dịch axit mạnh như HCl, H₂SO₄ loãng, HNO₃ đều hòa tan được Al(OH)₃.
2. Các dung dịch kiềm dư hòa tan được Al(OH)₃
Cơ chế: Al(OH)₃ có tính axit yếu, nên trong dung dịch kiềm mạnh và dư (NaOH, KOH), nó tạo ra muối aluminat tan. Vậy nên dung dịch nào sau đây hòa toạn được Al(OH)₃?
Ví dụ cụ thể:
Dung hòa AlOH3
Với NaOH: Al(OH)₃+NaOH → Na[Al(OH)₄]
Với KOH: Al(OH)₃+KOH → K[Al(OH)₄]
Kết luận: Các dung dịch kiềm mạnh và dư đều hòa tan được Al(OH)₃, minh chứng rõ cho tính chất lưỡng tính của nó.
3. Các dung dịch không hòa tan được Al(OH)₃
Dung dịch muối trung tính (NaCl, KNO₃, BaCl₂...): Không có khả năng hòa tan vì không tham gia phản ứng với Al(OH)₃. Vậy nên dung dịch nào sau đây hòa toạn được Al(OH)₃?
Dung dịch kiềm loãng, không dư: Chỉ tạo kết tủa Al(OH)₃, không làm tan được. Ví dụ: Al³ ⁺+3OH⁻ → Al(OH)₃ (kết tủa trắng).
Dung dịch axit yếu (CH₃COOH, H₂CO₃): Không đủ mạnh để phản ứng hết với Al(OH)₃ nên không làm tan được đáng kể.
4. Tóm lại – Dung dịch nào hòa tan được Al(OH)₃?
Axit mạnh: HCl, H₂SO₄ loãng, HNO₃.
Kiềm mạnh dư: NaOH, KOH (trong dung dịch đặc hoặc dư).
Đây là hai nhóm dung dịch duy nhất có khả năng hòa tan Al(OH)₃, do cơ chế phản ứng trung hòa axit– bazơ và tạo phức aluminat.
5. Ý nghĩa trong học tập và bài thi
Câu hỏi “ Dung dịch nào sau đây hòa tan được AlOH3” thường xuất hiện trong đề thi trắc nghiệm Hóa học lớp 12 và thi THPT Quốc gia.
Học sinh cần ghi nhớ: Axit mạnh+Kiềm mạnh dư → luôn hòa tan được Al(OH)₃.
Đây cũng là một cách nhanh để loại trừ các đáp án gây nhiễu như muối trung tính hay axit yếu.
1. Ứng dụng trong công nghiệp luyện nhôm
Phương pháp Bayer: Đây là quy trình sản xuất nhôm oxit (Al₂O₃) từ quặng bôxit chứa Al(OH)₃ hoặc AlO(OH). Trong giai đoạn đầu, quặng được xử lý bằng dung dịch NaOH đặc, Al(OH)₃ sẽ tan tạo thành dung dịch natri aluminat:
Al(OH)₃+NaOH → Na[Al(OH)₄]
Sau đó, dung dịch được làm nguội và kết tủa Al(OH)₃ trở lại để thu được Al₂O₃ sau khi nung.
Ý nghĩa: Đây là bước quan trọng trong công nghiệp luyện nhôm, giúp tách nhôm ra khỏi tạp chất như Fe₂O₃, SiO₂.
2. Ứng dụng trong y học
Chất kháng axit: Một số thuốc dạ dày chứa Al(OH)₃, khi uống vào, Al(OH)₃ sẽ phản ứng với axit HCl dư trong dịch vị, làm giảm độ axit, giúp giảm đau rát và viêm loét dạ dày:
Al(OH)₃+3HCl → AlCl₃+3H₂O
Ưu điểm: Không gây tác dụng phụ mạnh như một số thuốc kháng axit khác, lại có khả năng tạo lớp bảo vệ niêm mạc dạ dày.
3. Ứng dụng trong xử lý môi trường
Xử lý nước thải: Nhờ khả năng kết tủa và tan trong môi trường kiềm hoặc axit, Al(OH)₃ thường được sử dụng để loại bỏ các ion kim loại nặng hoặc tạp chất trong nước thải công nghiệp.
Cơ chế: Trong môi trường thích hợp, Al(OH)₃ có thể hấp phụ các chất độc hại và kết tủa xuống đáy, từ đó làm sạch nguồn nước.
4. Ứng dụng trong nghiên cứu hóa học và thí nghiệm
Kiểm chứng tính lưỡng tính: Trong phòng thí nghiệm phổ thông, phản ứng hòa tan Al(OH)₃ trong axit và kiềm thường được dùng để minh họa hiđroxit lưỡng tính.
Hỗ trợ phân tích định tính: Các phản ứng đặc trưng này giúp học sinh phân biệt Al³ ⁺ với các ion kim loại khác, chẳng hạn như Fe³ ⁺ (Fe(OH)₃ không tan trong kiềm dư).
5. Ứng dụng trong học tập và ôn thi
Dạng bài tập trắc nghiệm: Câu hỏi “ Dung dịch nào sau đây hòa tan được AlOH3” thường được đưa vào đề thi THPT Quốc gia, giúp kiểm tra khả năng phân biệt tính lưỡng tính của học sinh.
Phương pháp ghi nhớ nhanh: Chỉ cần nhớ 2 nhóm dung dịch chính: Axit mạnh (HCl, H₂SO₄ loãng, HNO₃) và Kiềm mạnh dư (NaOH, KOH) là đủ để trả lời đúng.
Ý nghĩa học thuật: Giúp học sinh hiểu rõ bản chất của phản ứng thay vì chỉ học thuộc lòng, từ đó áp dụng linh hoạt vào các dạng bài khác nhau.